pH vody
pH je měřítkem toho, jak je kyselá / zásaditá voda. Rozsah pH se pohybuje od 0 do 14, přičemž 7 je neutrální. pH nižší než 7 indikuje kyselost, zatímco hodnota pH vyšší než 7 znamená zásaditost. pH vody je velmi důležitým měřítkem kvality vody.
pH a voda
Nepříliš často slyšíte ve zpravodajství říkat „Dobrý den, dnešní hodnota pH vody v Praze je 6,5“ Nicméně pH je poměrně důležité měření kvality vody. Nejen, že pH ovlivňuje organismy žijící ve vodě, měnící se pH může být indikátorem rostoucího znečištění nebo nějakého jiného faktoru životního prostředí.
pH je měřítkem toho, jak je kyselá / zásaditá voda. Rozsah se pohybuje od 0 do 14, přičemž 7 je neutrální. pH nižší než 7 indikuje kyselost, zatímco hodnota pH vyšší než 7 znamená zásaditost. pH je skutečně měřítkem relativního množství volných vodíkových a hydroxylových iontů ve vodě. Voda, která má více volných vodíkových iontů, je kyselá, zatímco voda, která má více volných hydroxylových iontů, je zásaditá. Protože pH může být ovlivněno chemikáliemi ve vodě, pH je důležitým ukazatelem vody, která se chemicky mění.
pH je uvedeno v „logaritmických jednotkách“. Každé číslo představuje desetinásobnou změnu kyselosti / zásaditosti vody. Voda s pH 5 je desetkrát kyselejší než voda o pH 6.
Význam pH
pH vody určuje rozpustnost (množství, které může být rozpuštěno ve vodě) a biologickou dostupnost (množství, které může být využito vodním životem) chemických složek, jako jsou živiny (fosfor, dusík a uhlík) a těžké kovy (olovo, mědi, kadmia atd.). Například, kromě toho, jak ovlivňuje, kolik a jaká forma fosforu je ve vodě nejhojnější, pH také určuje, zda jej může používat vodní život. V případě těžkých kovů určuje stupeň jejich rozpustnosti jejich toxicitu. Kovy mají tendenci být toxičtější při nižším pH, protože jsou rozpustnější. Proto je voda s “kyselým” pH nevhodná pro pití.

Schéma pH
Jak ukazuje tento diagram, pH se pohybuje od 0 do 14, přičemž 7 je neutrální. pH nižší než 7 jsou kyselé, zatímco pH vyšší než 7 jsou alkalické (zásadité). Normální srážky mají pH okolo 5,6 – mírně kyselé v důsledku plynného oxidu uhličitého z atmosféry. Vidíte, že kyselý déšť může být velmi kyselý a může negativně ovlivnit životní prostředí.
pH stupnice
Stupnice pH se pohybuje od 0 do 14, přičemž 7 je neutrální. pH nižší než 7 jsou kyselé, zatímco pH vyšší než 7 jsou alkalické (zásadité).
Měření pH
pH je důležité měření vody, které se často měří jak na místě odběru vzorků, tak v laboratoři. Existují velké a malé modely pH metrů. Přenosné modely jsou k dispozici, aby se v terénu a větší modely, jako je tento, se používají v laboratoři.

Pro použití pH metru se vzorek vody umístí do šálku a skleněná sonda na konci výsuvného ramene se umístí do vody. Uvnitř tenké skleněné žárovky na konci sondy jsou dvě elektrody, které měří napětí. Jedna elektroda je obsažena v kapalině, která má pevnou kyselost nebo pH. Druhá elektroda reaguje na kyselost vzorku vody. Voltmetr v sondě měří rozdíl mezi napětími obou elektrod. Měřič pak převádí napěťový rozdíl na pH a zobrazí ho na malé obrazovce na hlavním boxu.
Před měřením pH musí být přístroj „kalibrován“. Sonda je ponořena v roztoku, který má známé pH, jako je čistá voda s neutrálním pH 7,0. Knoflíky na krabici slouží k nastavení zobrazené hodnoty pH na známé pH roztoku, čímž se kalibruje měřidlo.
Jedním z nejpopulárnějších školních vědeckých projektů je vzít pH vody z různých zdrojů. Šance je, že vaše škola (a rozhodně ne vy) nemá elektronický pH metr, ale můžete stále odhadnout pH pomocí lakmusového papíru. Papír s lakmusem, který lze nalézt na prodejnách pro domácí zvířata (ke kontrole pH akvárií), je prostě pruh papíru, který, když na něj spadne vzorek vody, změní určitou barvu a poskytne hrubý odhad pH.
pH a kvalita vody
Příliš vysoká a nízká hodnota pH může být na újmu
Kyselost povrchových vod a pH v našem prostředí
Hlavním zdrojem vodíkových iontů (určujících hodnotu pH) jsou srážkové vody, jejichž pH vlivem průmyslových exhalací (především SO2 a NOx) klesalo až na hodnotu pH < 4. Hlavní příčinou jsou kyselina sírová (H2SO4) a dusičná (HNO3) vznikající v atmosféře a na po vrchu vegetace oxidací uvedených plynů. Dalšími zdroji H+ iontů jsou pak zejmé na nitrifikace amonných iontů v půdách a odběr bazických kationtů biomasou.
Hodnota pH povrchových vod je pak výsledkem rovnováhy ustavené po interakci srážkové vody s půdami a horninou a závisí na kyselosti srážek, geochemické reaktivitě horniny (její schopnosti neutralizovat kyselé vody) a délce kontaktu vody s horninou. Dalším (přirozeným) zdrojem kyselosti v povrchových vodách jsou organické kyseliny (především huminové kyseliny a fulvokyseliny), které jsou produktem rozkladu organické hmoty v půdách a zejména v rašeliništích.
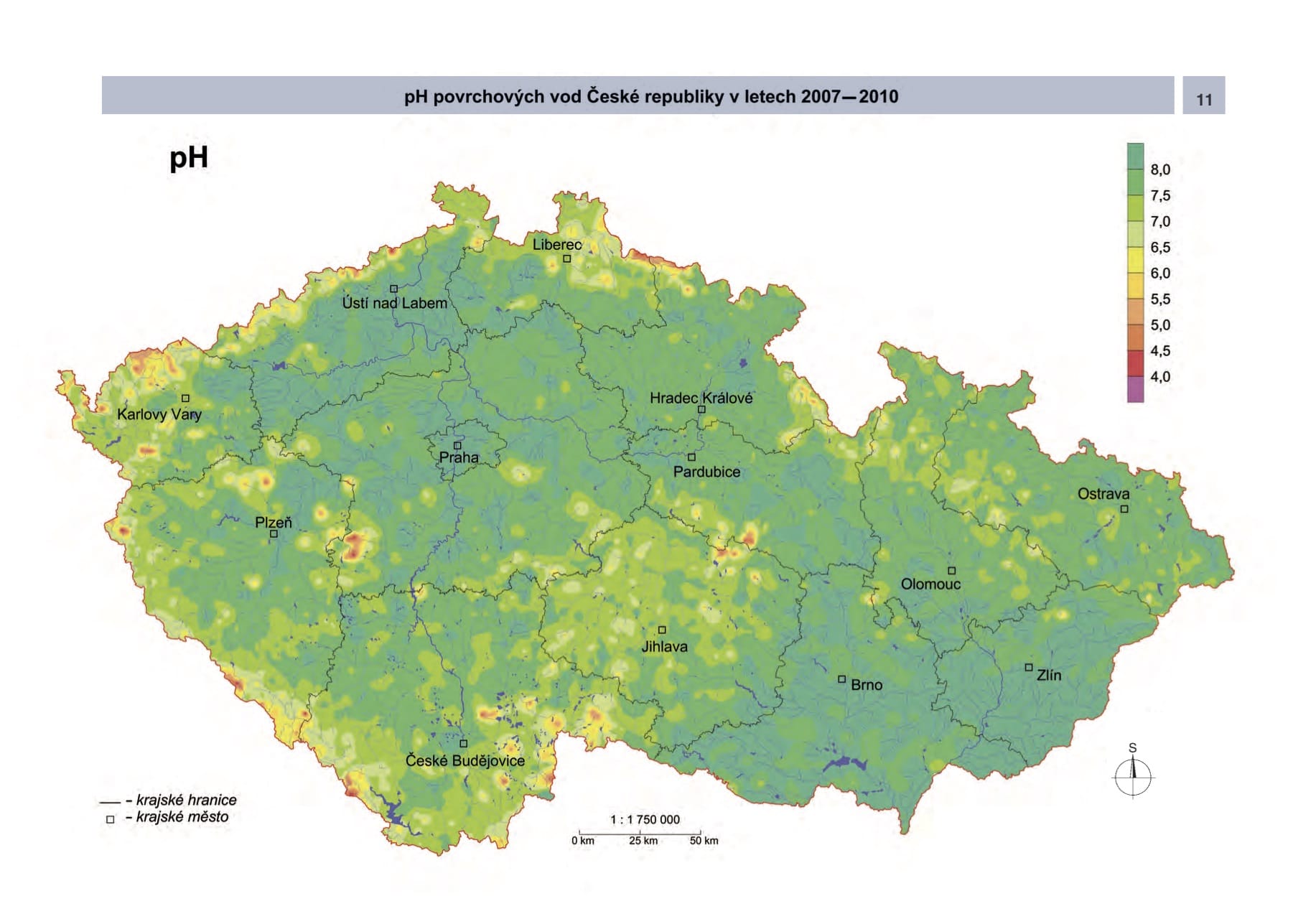
(zdroj: Česká geologická služba)
pH v našem kohoutku
Voda, která nám doma v ČR teče z kohoutku má zpravidla neutrální pH. Česká norma stanoví limit pH 6,5 – 9,5. Abychom pomohli našemu tělu zvýšit jeho pufrovací kapacitu, tedy schopnost udržovat tělu v acidobazické rovnováze, můžeme si pořídit ionizátor vody, který vyrobí zásaditou vodu na pití. Zásaditá voda pomáhá tělu neutralizovat kyseliny a má další zdravotní benefity.
